Western blot可以用于蛋白含量的测定,对其进行(半)定量分析。我们在论文中经常会看到除了Western blot条带图片之外,还会附带一个条带量化分析的柱状图,更为直观和客观地展示表达量的差别。

图源:Wiel C, Le Gal K, Ibrahim M X, et al. BACH1Stabilization by Antioxidants Stimulates Lung Cancer Metastasis[J]. Cell, 2019.
这种图的数据一般是通过Image J或者IPP等位图分析软件获得的。在Image J里面量化分析Western blot条带的方法有两种,一种是“面积法”,一种是“反相加和灰度法”。一般情况下,这两种方法测量的都不是光密度,需要校正之后才会测到光密度。但是没关系,这两种方法测得结果和光密度之间存在线性对应关系,都可以对Western blot结果进行(半)定量描述。
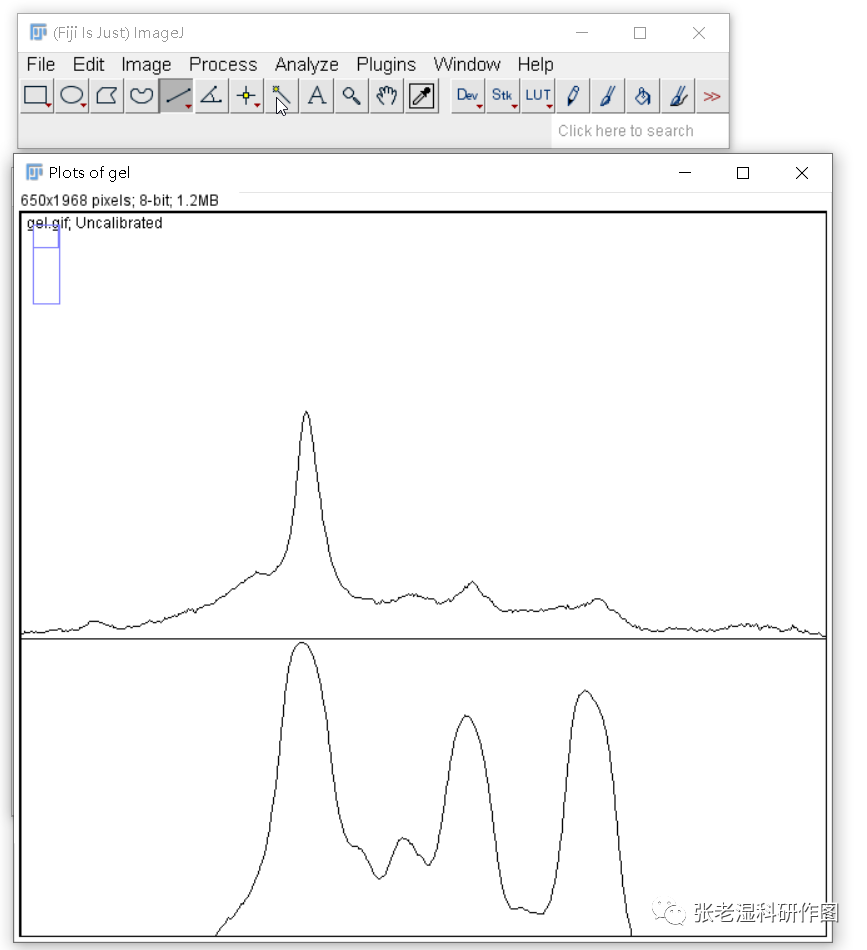
所谓面积法,是Image J通过扫描Western bolt条带的灰度值变化,综合考虑灰度值和面积,画出一条带峰的曲线,然后以峰面积来表示蛋白表达量。
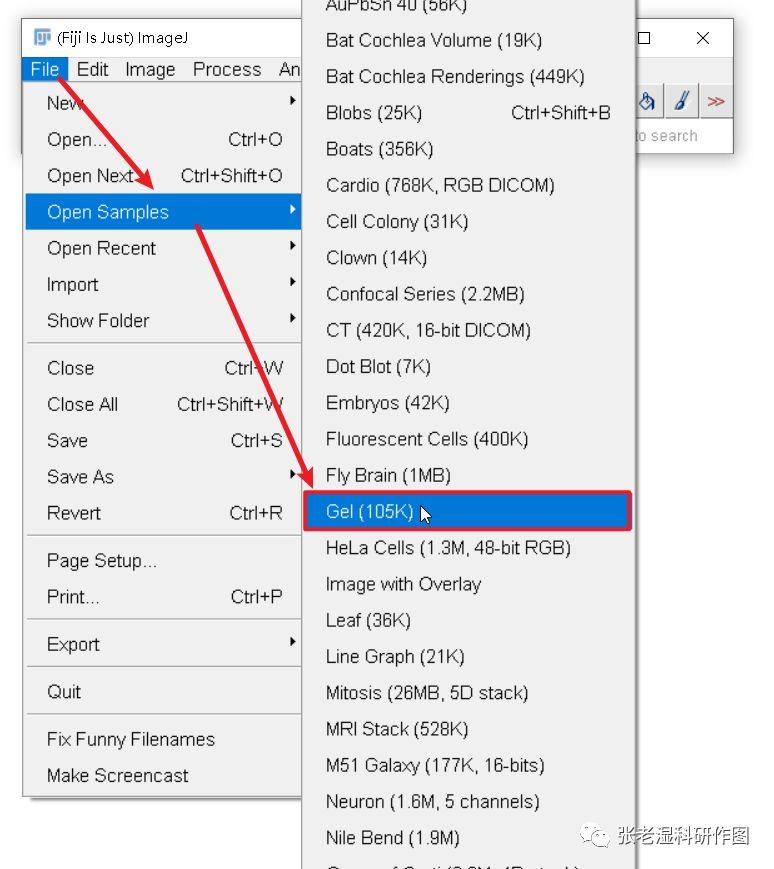
1.打开需要测量的图片或者Image J自带的例图,本文使用自带例图;
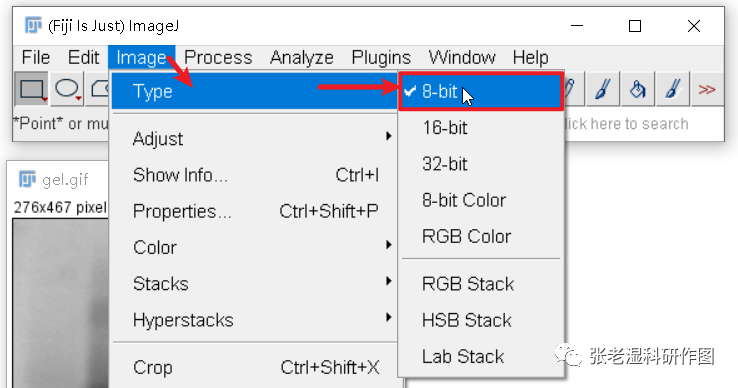
2.对图片进行整体的基础调整:颜色模式改为8bit灰度模式、色阶调整;
8bit的单通道灰度模式是绝大多数计算和命令所需要的前提处理,不改成这模式进行后续处理会有报错提示。转变成8 bit之后,图片变成黑白(其实是灰度图),每个像素按照从最黑到最白用一个0~255之间的一个值来表示,便于后续计算。
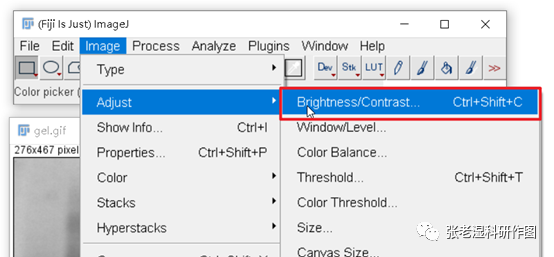
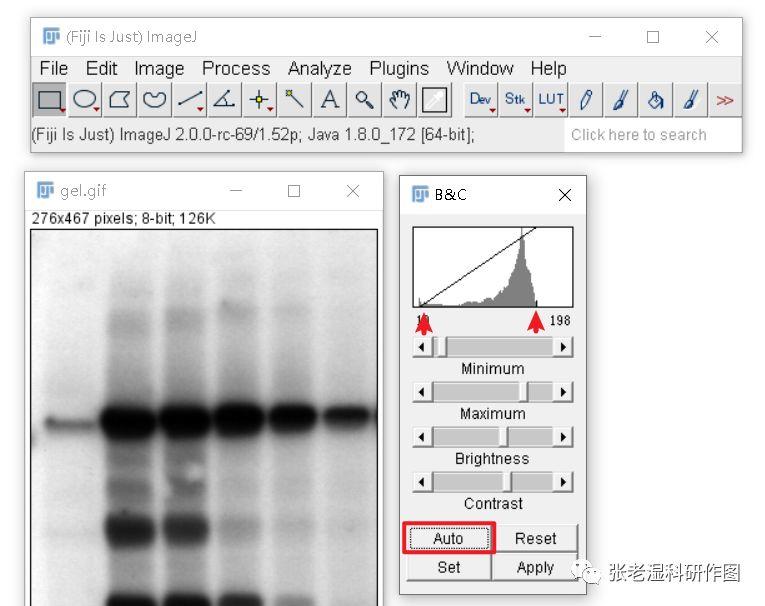
Brightness/Contrast(亮度/对比度)调整其实就是一个色阶调整,需要把图片直方图最小色阶值和最大色阶值往直方图两端出现值的地方调整,让图片的有效像素色阶范围更宽,颜色和颜色之间的区分度更大。放心,色阶和对比度调整是灰阶值的线性变化,是SCI稿约允许的常规调整,不会影响结果的比较。
一般Auto(自动)调整就能达到较好的效果,但是也要注意看直方图作为检查,有时候Auto不尽人意就要手动调整了。
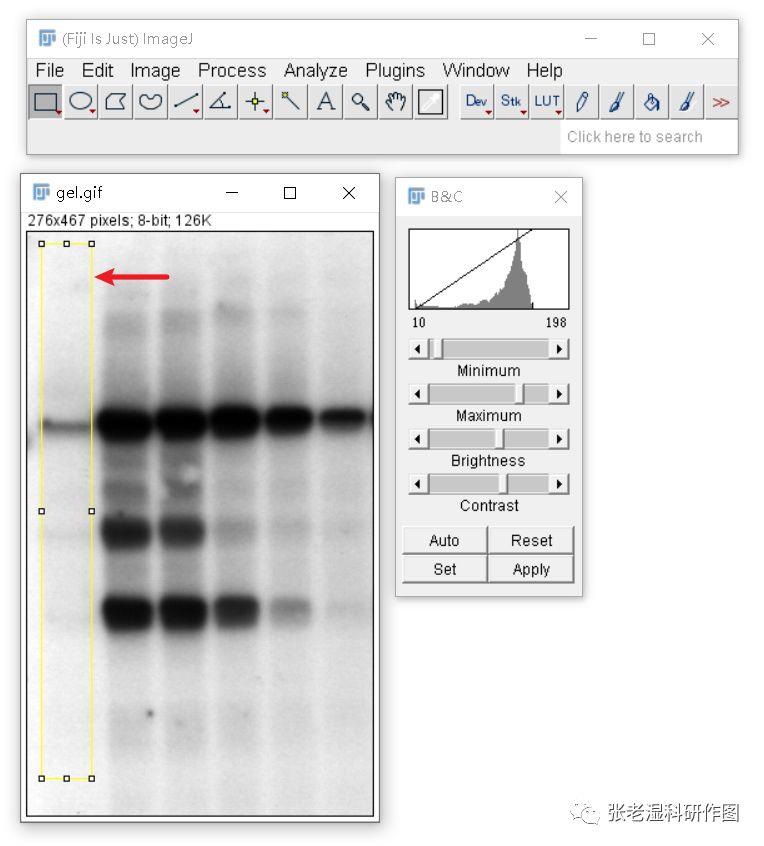
3.使用矩形选框工具按照所需选取条带,可以水平框选,也可以竖直框选,下图是竖直框选;
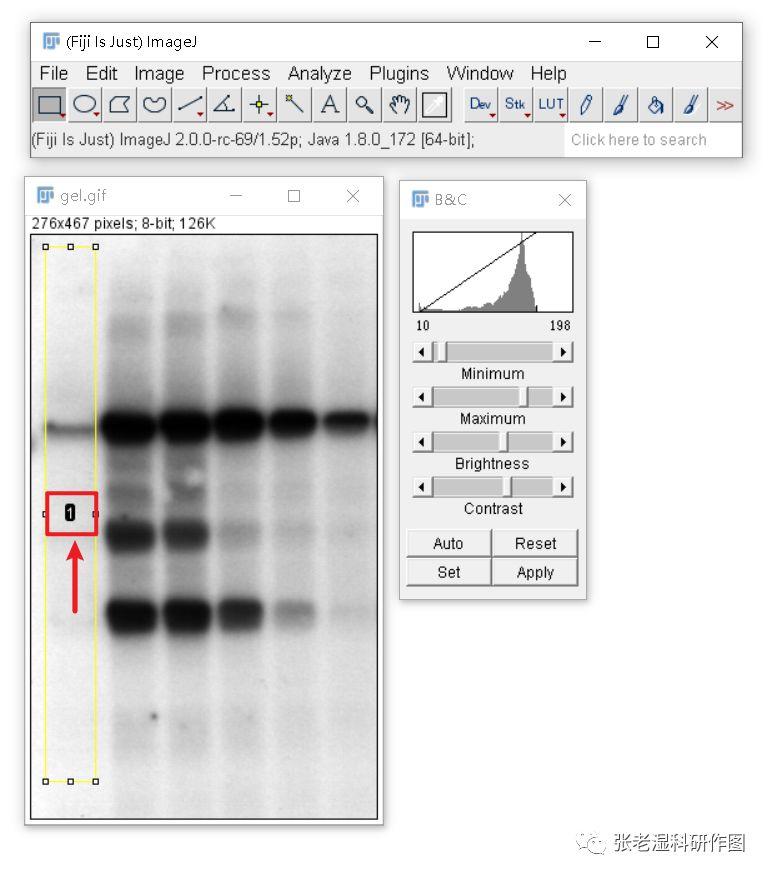
4.选择 Analyze>Gels>Select First Lane (快捷键Ctrl+1或1),条带上会出现数字1标记;
5.移动矩形选框,选择Analyze>Gels>Select Next Lane(快捷键Ctrl+2或2),框住另外的条带,条带上会出现数字2标记;
6.重复步骤3,框选完剩下所有条带,条带上会依次出现数字标记;
7.Analyze>Gels>PlotLanes( 快捷键Ctrl+3或3),获得条带选区曲线图;
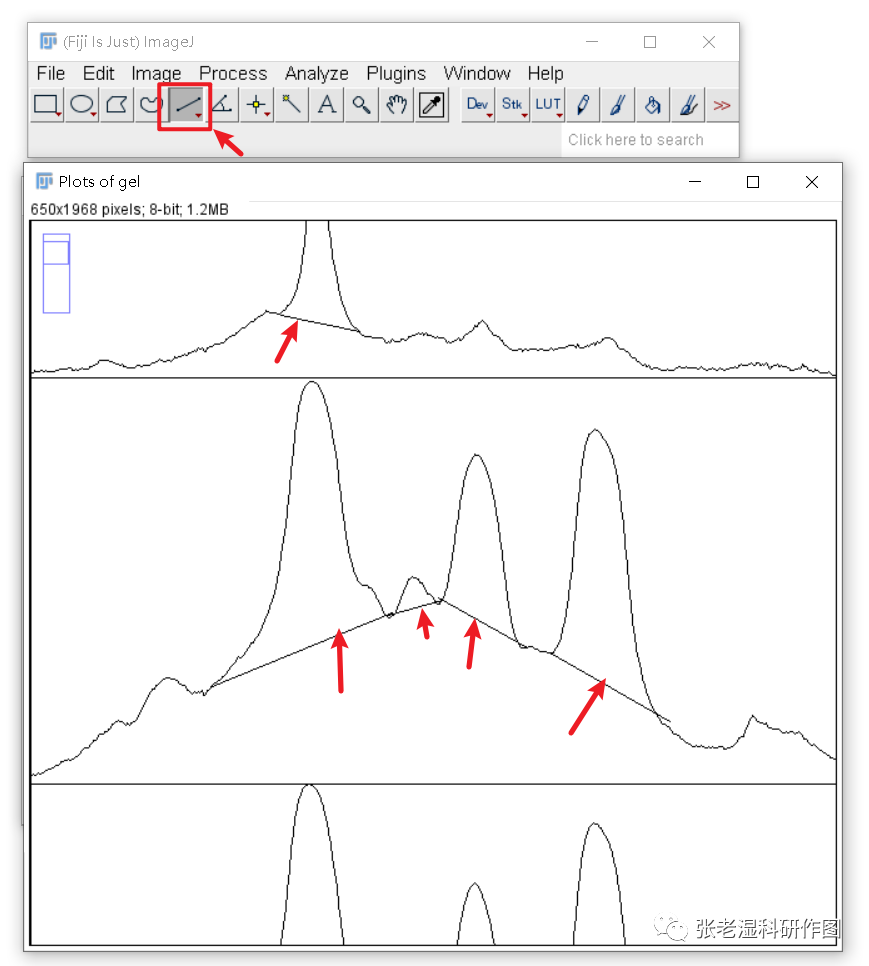
8.利用直线工具对条带选区曲线图中的峰进行封底(注意,是封底,不是向下分割);
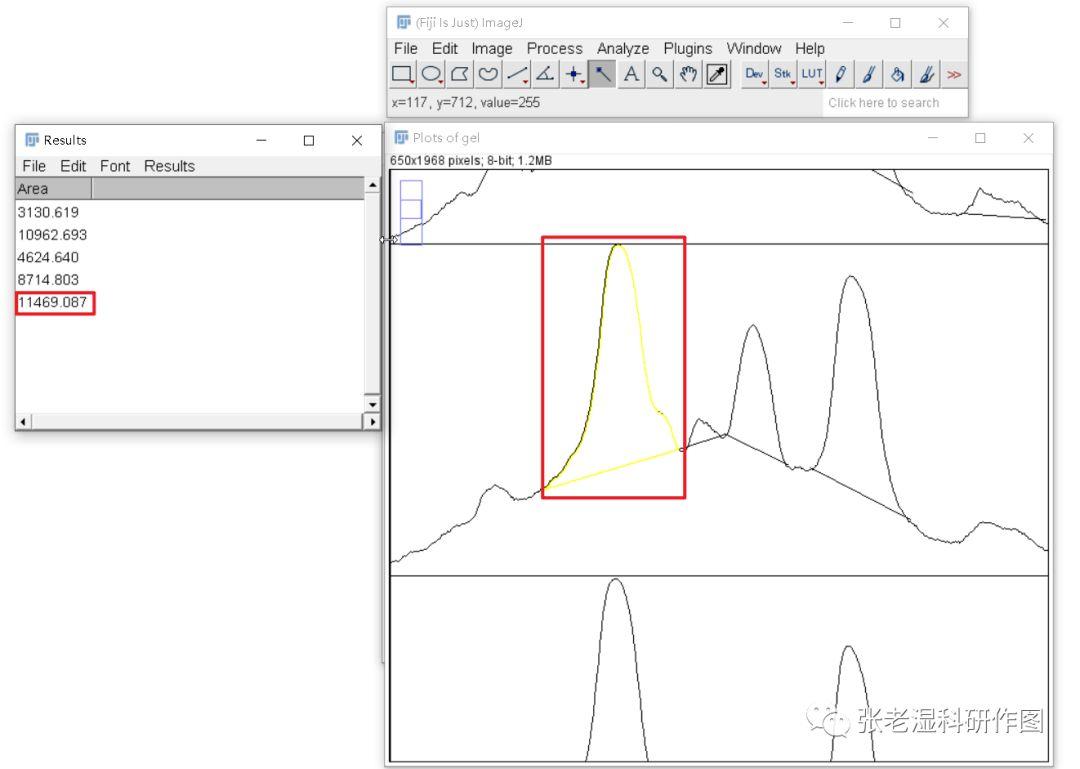
9.利用魔棒工具选择封闭峰形,测量峰面积。点哪一个峰,峰就会被黄色线条框住,并会测出一个面积,这个面积可以用来(半)定量表示条带所表示的蛋白量。多做几次重复试验,获得多张图片,就可以获得平行数据,然后统计分析画柱状图即可。
这种采用直线封底的方法,其实是扣除了背景值的。因为在曲线上,纵坐标值只有显著高于背景值才会出峰。
1.打开图片,对图片进行整体的基础调整:颜色模式改为8bit灰度模式、色阶调整,见前一个方法;
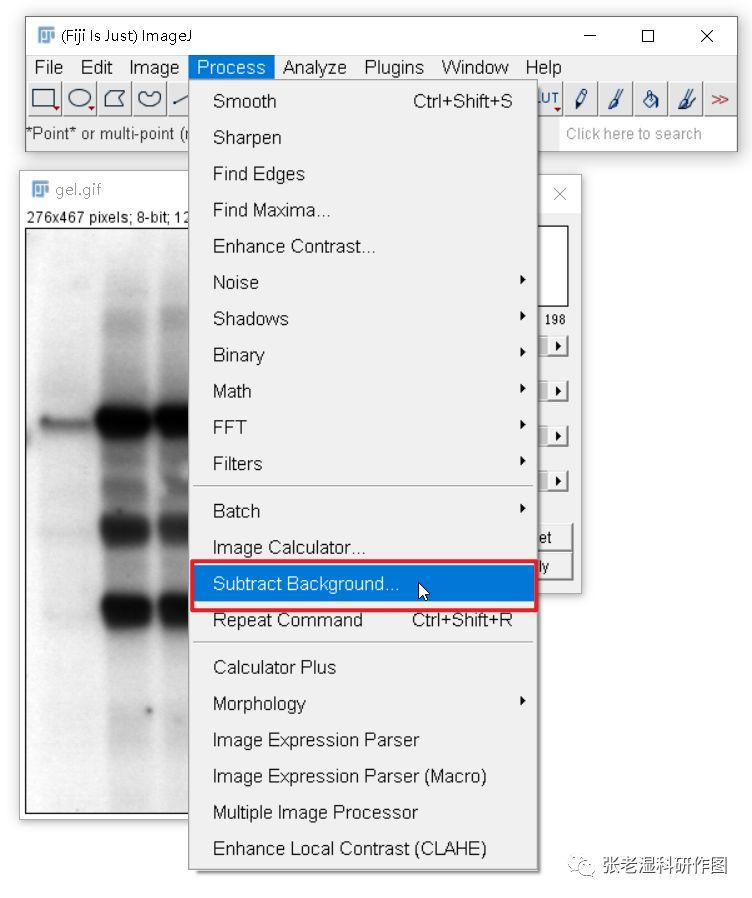
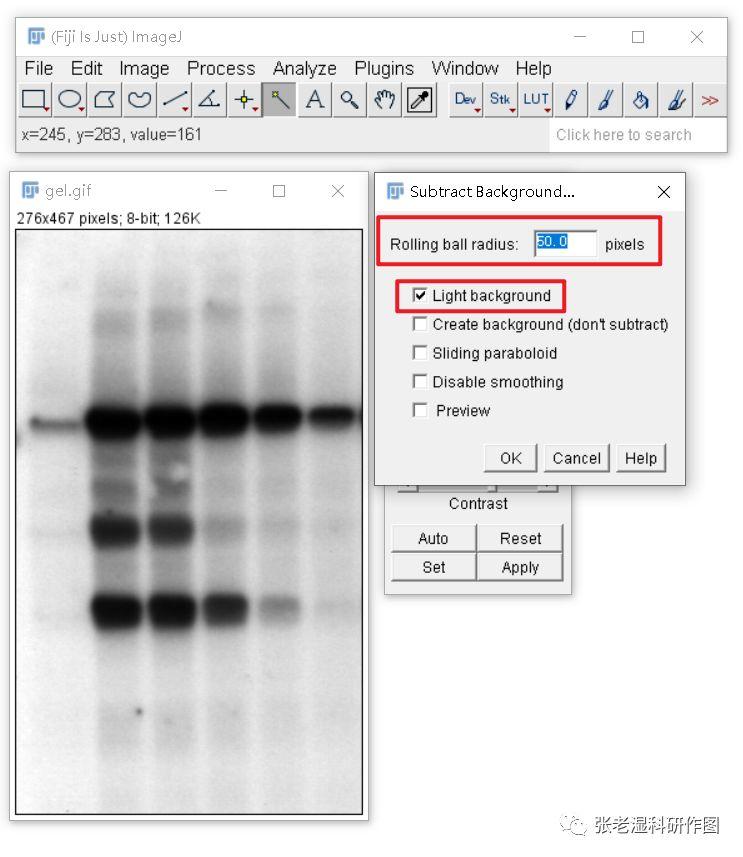
2.背景校正(Process/Subtract Background )
软件会利用一个所谓的“滚球(rolling ball)”算法,扣除部分背景,不懂怎么设置滚球半径就用默认参数“50 pixels”即可,还要勾选“Light background”。这一步会让背景尽量变白,其实如果你通过Brightness/Contrast(亮度/对比度)调整让背景尽量变白也可以,甚至效果更好。这一步是为下一步做准备。
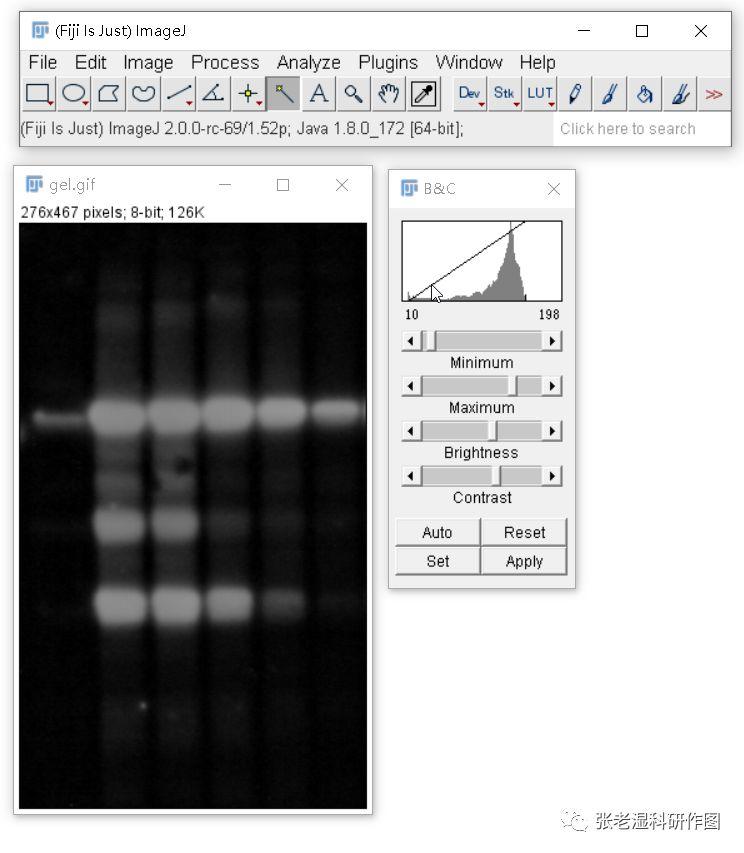
因为在8 位色阶里面,把最黑的灰阶值定义为0,而把最白的灰阶值定义为255,从最黑到最白总共有2的8次方(256)种灰阶值。通过反相,可以把前一步获得的白色背景变成灰阶值接近于0的黑色,而把原来的黑色条带变成灰阶值接近255的白色,在下一步测量的时候,如果圈选到背景值,干扰就会小,结果会尽可能地准确。
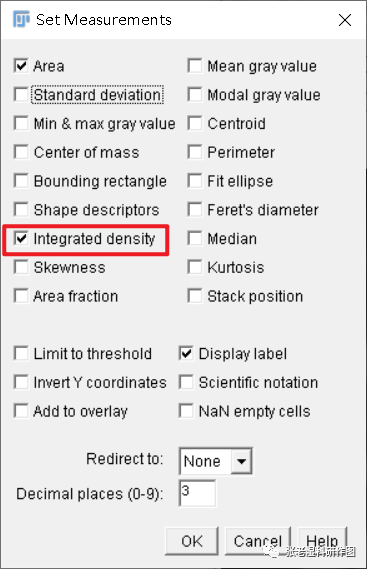
4.测量选项设置:Analyze/Set Measurements,勾选Integrated Density(加和密度值)。Integrated Density(加和密度值)是一个不带属性的计算方式,具体最后测出来的是什么,要看图像的每个像素代表着什么,比如本例中代表的是灰阶值,那最后测出来的就是“加和灰阶值”;如果经过校正并让每个像素表示光密度值,那么最后测出来的就是“加和光密度值”。
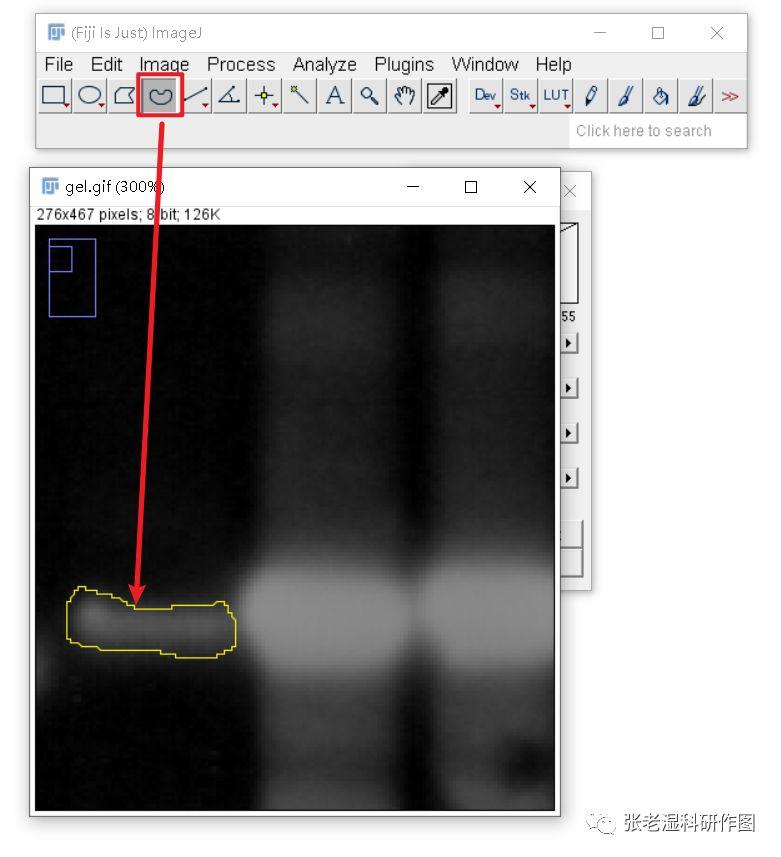
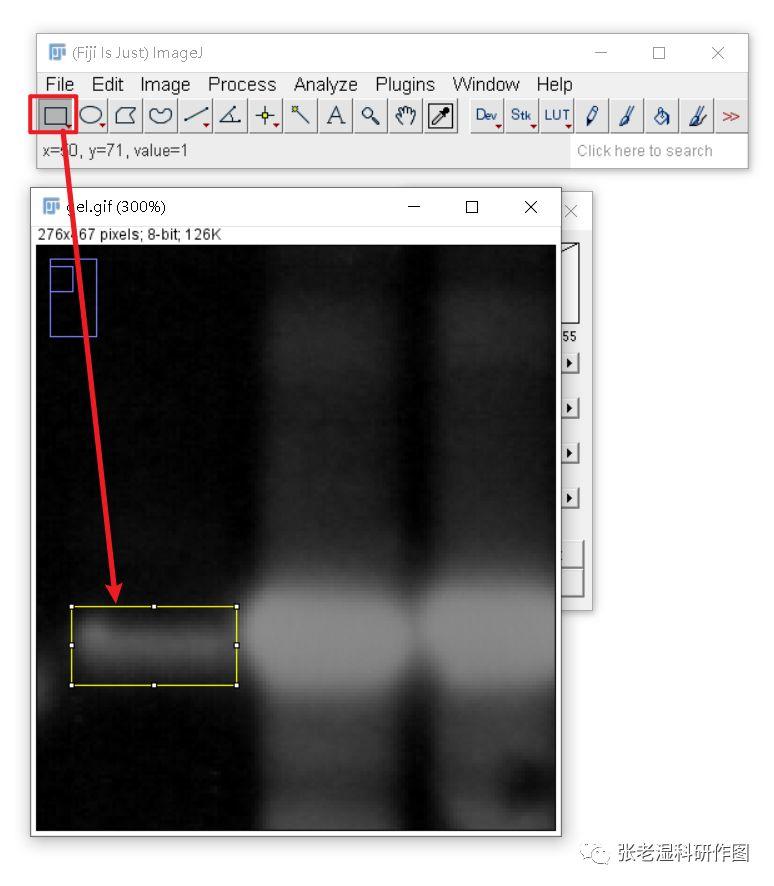
5.选取需要测定的区域。可以使用自由曲线比较精确地勾画选区,这样对于有背景干扰的图像会准确一些;也可以偷懒使用规则的矩形或者圆角矩形来勾画选区,由于背景已经反相,黑色区域接近于0,所以误差也不大;
下图用矩形大概框选条带,选框明明比条带区域要大一些,但是由于大出来的区域都是黑色,色阶值接近于0,对最终测得的加和灰阶值影响不大。
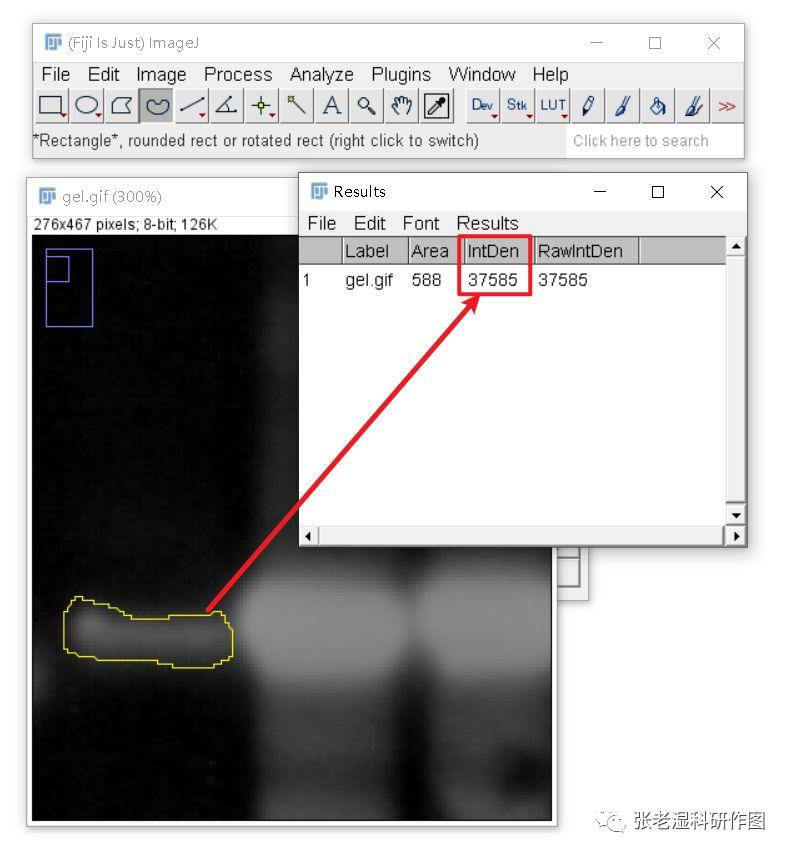
6.测量(Analyze/Measure,快捷键Ctrl+M),获得的IntDen(加和灰度值)即可以用于定量描述蛋白表达量;
7.重复第6步,完成剩余条带的选取和测量。多做几次重复试验,获得多张图片,就可以获得平行数据,然后统计分析画柱状图即可。
总体而言,“面积法”的操作会简单一些;但是“反相加和灰度法”对于一些条带挨得比较近、不太整齐的电泳图会准确一些。
https://imagej.nih.gov/ij/docs/examples/dot-blot/index.html
https://imagej.nih.gov/ij/docs/menus/process.html#background
https://imagej.nih.gov/ij/docs/menus/analyze.html#gels
https://imagej.nih.gov/nih-image/manual/tech.html#analyze
原文始发于微信公众号(张老湿科研作图):高分文献中的Western Blot定量柱状图是如何实现的?



 如图所示|张老湿科研绘图
如图所示|张老湿科研绘图